Raziskovalec mora biti trmast in vztrajen, pravi profesor Hrvoje Petković, ki na Biotehniški fakulteti predava vsebine iz mikrobne in industrijske biotehnologije, predvsem oblikovanje novih učinkovin. Z različnimi biotehnološkimi postopki mikrobe "prepriča", da ustvarijo snov z želenimi lastnostmi.
Po študiju živilstva v Zagrebu se je na doktoratu v Ljubljani posvetil molekularni genetiki, izpopolnjeval pa v Angliji, kjer je na Univerzi v Cambridgeu sodeloval pri več v znanosti odmevnih raziskavah in vodil raziskovalno skupino v okviru sodelovanja s podjetjem Biotica. Tudi po vrnitvi v Slovenijo se je ukvarjal s celo vrsto projektov, osrednja tema njegovega dela pa so tetraciklini – antibiotiki z zelo širokim delovanjem, intenzivno se uporabljajo v veterini in za zdravljenje v humani medicini, za zdravljenje spolno prenosljivih bolezni, bolnišničnih okužb (MRSA), lymske borelioze, okužb dihal, sečil in oči, celo proti malariji.
Ker je aplikativno naravnan, vselej išče načine, kako najnovejša spoznanja prenesti v nekaj otipljivega in uporabnega. Pred kratkim je v sodelovanju z dr. Tjašo Danevčič mentoriral magistrsko delo o tem, kako se "mikroorganizmi pogovarjajo v naravi". Prepričan je, da nam tovrstna znanja pomagajo odkriti nove metode za odkrivanje in razvoj novih biološko aktivnih učinkovin. Velikokrat pa se zgodi, da je prva predikcija napačna, da snov deluje povsem drugače, kot se predvideva.
Pogovori na Univerzi v Ljubljani
Za primer navede rapamicin, snov, ki so jo sprva preiskovali zaradi njenega protiglivnega delovanja, potem uporabnosti pri presajanju organov (zavira namreč odziv imunskega sistema na presadek), danes je zanimiva v bitki proti raku, v prihodnosti pa utegne postati celo učinkovit in dostopen zaviralec staranja. Prav z rapamicinom se je ukvarjal v Cambriedgeu, pa tudi z branjem genoma bakterije Streptomyces coelicolor, v Sangerjevem centru. Napredek je izreden. Takrat je bil projekt vreden 2 milijona funtov in ga je izvajala zadevna raziskovalna skupnost celotne Velike Britanije. Danes branje genoma stane okoli 1000 evrov, čez deset let bo morda le še 10 evrov, razmišlja. Biotehnologija je od podveje živilstva – peke, vinarstva in kisanja – prešla na nekoč nepojmljiva področja genske manipulacije in izdelave nadvse zapletenih organskih molekul, ki jih zgolj s kemijskimi postopki ni mogoče ustvariti. A Petković tu opozarja na še večje novosti, kot je umetna, zunajcelična sinteza kratkih beljakovin, z izjemno biološko aktivnostjo, kar je pred kratkim uspelo nekemu japonskemu znanstveniku. Vse to zgovorno kaže, kako kompleksna in interdisciplinarna veda biotehnologija postaja.

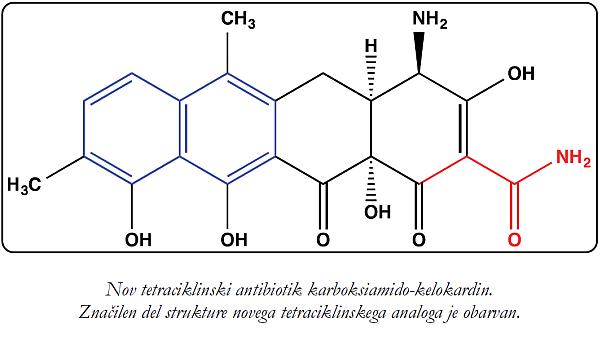
Širši javnosti ste verjetno najbolj znani kot soustanovitelj podjetja Acies Bio, še zlasti, ker ste s tem podjetjem odkrili nov tetraciklinski antibiotik, imenovan karboksiamaido-kelokardin. Naj poudarim, da so dandanes novi antibiotiki precejšnja redkost. Na kateri stopnji so te raziskave danes? Ali pri tem s kom sodelujete?
To je eden izmed projektov. Še teče, zdaj je v predklinični fazi, torej pri poskusih na miškah. Nekaj razgovorov z velikimi podjetji smo že imeli in potekajo naprej. Seveda ne v Sloveniji, pri nas za to ni institucije. Razvoj takšne učinkovine pomeni gromozanske stroške, Lek, kot primer, je sicer finančno dovolj močan, vendar razvija generična zdravila. Je pa tudi res, da je to zdaj že Aciesova in Helmholtzeva zgodba, jaz osebno nisem več neposredno angažiran. Seveda, še vedno pa raziskujemo na tem področju v obsegu dela raziskovalne skupine na Biotehniški fakulteti in v sodelovanju z Aciesom Bio.
Kelokardin je že v 70. letih, sicer v omejenem obsegu, klinično testiralo podjetje Abbott, in to na Hrvaškem. Je torej vaše raziskovanje povezano s študijem v Zagrebu? Kako se je vse skupaj začelo?
Ne, zgodilo se je čisto po naključju, učinkovina se mi je zdela obetavna. Namreč – kelokardin ima popolnoma drugačen način delovanja, čeprav ima strukturo podobno tetraciklinom, ki jih uporabljamo v medicini. Tetraciklini se navadno vežejo na ribosom, kelokardin pa ne. Pri raziskovanju tega pojava smo "naleteli" na neki članek, ki ga očitno ni opazil nihče drug – napisan je bil v hrvaščini – in ugotovili, da je bila opravljena že druga faza kliničnih testov na 12 pacientih. To me je spodbudilo in zelo sem se trudil, da bi našel koga, ki je sodeloval pri preizkušanju tega antibiotika v Zagrebu, a nisem bil uspešen, saj so se sodelujoči že vsi upokojili. Pa sem se rekel: Nič, poskusimo sami! Torej smo proizvedli učinkovino in ugotovili, da je njena aktivnost odlična. Začeli smo poglobljeno raziskovati, klonirati gene, ki kodirajo biosintezo tega antibiotika, jo izboljševati z naprednimi metodami genskega inženirstva. Tako smo ustvarili analog, ki ima štirikrat boljšo aktivnost in deluje tudi proti po Gramu negativnim bakterijam – te danes povzročajo največ težav. Potem smo dobili evropska sredstva za prenos tehnologije iz visokega šolstva v industrijo, okoli 105.000 evrov. Ker sem takrat s podoktorskimi študenti ustanovil podjetje Acies Bio, je to prevzelo licenco za projekt od Univerze v Ljubljani in vodilo raziskave naprej. Ko je bilo treba izvajati tudi zahtevnejša dela, kot je predklinično testiranje, smo začeli sodelovati z Inštitutom Helmholtz. To je velik nemški inštitut, zaposluje okoli 35.000 raziskovalcev in dela neposredno z industrijo.
Z vsako novo tehnologijo prihajajo pomisleki. Potreben je čas, da se metoda izpopolni in dokaže v praksi. Zadeve ne moremo odpraviti kar z besedami, češ da ni nevarna. A v prihodnosti brez GSO-jev prav gotovo ne bo šlo.
Kakšen je potencial te učinkovine? Je njeno delovanje razmeroma univerzalno?
Da, ima širok spekter, navadno pa se učinkovina v nadaljevanju raziskav še dodatno profilira. Sedaj imamo indikacijo: predvsem za zdravljenje okužb sečil, ki jih povzročajo po Gramu negativni patogeni. Ti so v bolnišnicah kar resna težava. Obstaja tetraciklinski antibiotik tigeciklin, ki je po spektru aktivnosti relativno podoben kelokardinu. Smo blizu, naša učinkovina torej ni slaba. Pomemben je test, s katerim preverjamo, kako hitro se patogen navadi na antibiotik. To so v resnici precej preprosti testi. Patogena izpostavimo ultravijolični svetlobi ali drugim mutagenom, ter ga gojimo na gojišču z visoko koncentracijo testiranega antibiotika, pri kateri se bakterije sicer ne razmnožujejo več. Zanima nas, ali kaka mutanta vendarle preživi. Ko nabereš npr. 10 odpornih neodvisnih mutant, sekvenciraš in pregledaš njihove genome. Če vse izkazujejo mutacijo v istem genu, je to znak, da je prav s to mutacijo bakterija obšla delovanje antibiotika. Če je funkcija gena že znana, ni težko ugotoviti mesta delovanja. No, naš antibiotik tako rekoč ne dopušča preživelih mutant. Podatkov za analizo je tako premalo. Vendar pa hkrati to pomeni, da je antibiotik učinkovit.
Veliko se govori o odpornosti t. i. superbakterij. Ali zato razmišljate o kakem varovalnem mehanizmu? Recimo o dodatni snovi, ki bi preprečevala razvoj odpornosti, po zgledu kombinacije amoksicilina (penicilinski antibiotik) in klavulanske kisline?
Trenutno je klavulanska kislina tako rekoč edini primer takšne uporabe. Že v 70. so potekale raziskave, da bi odkrili učinkovine s podobnim načinom delovanja za kombiniranje z drugimi antibiotiki, pa jim ni uspelo. Pravzaprav gre za srečno naključje, da se klavulanska kislina po telesu giblje na enak način kot amoksicilin. Če bi se učinkovini obnašali različno, ne bi bili učinkoviti, tako pa so se ključni dejavniki pokrili. Klavulanska kislina in njeno delovanje s penicilinskim antibiotikom je zares izjemen fenomen. Njena uporaba se še širi. Lek je danes v svetovnem merilu eden največjih proizvajalcev, tako da je to za nas še posebno pomemben metabolit.
Zakaj pa rezistenca, kakor odpornost tudi imenuje stroka, sploh nastane?
Tega mehanizma, kakor vidim, nihče natančno ne razume. Lahko pa seveda jasno spremljaš posledice rabe nekega antibiotika. Najlepši primer so aminoglikozidi. Z njimi se tudi ukvarjam, pred kratkim smo o tem izdali eno lepo publikacijo. Gre za antibiotike, ki imajo vgrajene sladkorje, ki so po navadi opremljeni z aminoskupinami. Poznamo jih več: kanamicin, gentamicin, apramicin ... Če se antibiotik uporablja v velikih količinah, je odpornosti veliko. Če se uporablja malo, odpornosti ni. Poglejte primer gentamicina. Predpisuje se kar redko, ker škoduje ledvicam in ušesom. Uporabi se, ko je bolnik v tako zelo slabem stanju, da gre za vprašanje ur, ali bo preživel. Odpornosti je zaradi redke uporabe razmeroma malo, vendar se pojavlja. Še en aminoglikozidni antibiotik je apramicin. Kaže dobro aktivnost, a proti njemu skoraj ni odpornosti, zato ker se tako rekoč ne uporablja. Le nekaj malega v veterini. Podobno je pri drugih antibiotikih, npr. pri novih generacijah betalaktamov ... Očitno se pojav odpornosti uravnava s samo uporabo. Nikoli ne bo konca, to je evolucijska zadeva. Če imaš milijardo bakterij, bo ena pridobila črpalko, encim, nekaj pač, s čimer bo sposobna preživeti kljub prisotnosti antibiotika. Ta lastnost se nato lahko razširi z namnoževanjem te mutante ali pa celo s horizontalnim prenosom, torej nespolno z enega osebka na drugega (tudi med vrstami, op. p.). Zato moramo razvijati nove učinkovine ali pa odkriti popolnoma nove pristope zdravljenja okužb. In pa izobraževati zdravnike in uporabnike. To pomeni, da za vneto grlo z virusno infekcijo načeloma ne bomo uporabili antibiotika.
Nekoč ste poudarili, da pojav rezistence ne zadeva le bakterij samih. Ne gre le za to, da bi se razvile superbakterije, ki so sposobne obiti vse antibiotike, ampak gre za kompleksen splet več dejavnikov, npr. starost obolelih, prisotnost kroničnih soobolenj, zaradi katerih imunski sistem bistveno slabše deluje.
Tako je, tu so starejši ljudje z oslabljenim imunskim sistemom ... Neke napovedi so zelo grde. Bral sem, da bo po določenih predvidevanjih do 2035 v Evropi zaradi infekcij 40.000 bolnišničnih smrti letno. Ampak tega verjetno ne bo med mladimi, zdravimi in vitalnimi ljudmi. Gre za to, da se stara celotna populacija, zdravstveni zapleti pri njej so kompleksni. Ne gre le za samo okužbo.
Zdi se kot velika spodbuda za razvoj novih antibiotikov.
Na področju novih antibiotikov je trenutno velika kriza. Ko bo prva epidemija, bodo verjetno spet zanimivi, sicer pa za razvoj antibiotika med farmacevtskimi podjetji ni velikega zanimanja. Antibiotiki so tista zdravila, ki so za razvoj precej draga, po drugi strani pa je izkupiček od prodaje za farmacevtska podjetja razmeroma slab. Uporabiš jih namreč le nekajkrat, v kratkem časovnem obdobju, zelo močne antibiotike sploh zelo redko. Za primerjavo, zdravilo proti zvišanemu krvnemu tlaku pacient prejema vse življenje, kar za podjetje predstavlja konstanten zaslužek. Farmacevtski industriji se razvoj antibiotikov preprosto ne izplača. To je velik problem. Veliko se razmišlja, kako razrešiti ta položaj. Podjetju moraš omogočiti, da zasluži. Če ne zasluži, ne more razvijati naprej. Obstaja splošno prepričanje, da je farmacija zelo koruptirana, da se ne obnaša etično, a osebno sem bolj kritičen do živilske industrije. Tam je regulacije in kontrole nad porabo hrane mnogo manj. Dober primer tega so podjetja, ki izdelujejo sladke pijače, ki nam že leta prodajajo nevidni sladkor. Kar poglejte koruzne kosmiče in podobne izdelke. Povsod je sladkor. Žal negativne učinke občutimo šele, ko je že prepozno. Ta hip bi lahko problem porabe sladkorja celo primerjali s kajenjem. Sladkorna bolezen je v porastu, sladkorja pa kljub temu vedno več. Vsi se bojijo maščob, zato pa uživajo več ogljikovih hidratov, sladkorja in umetnih sladil. Pred kratkim sem na prvem programu slovenske nacionalne televizije gledal francosko dokumentarno oddajo – Francozi imajo odlične oddaje – o umetnih sladilih. Poglejte si to oddajo, zelo dobra je! Neka Angležinja je zdaj jasno pokazala, da se zredimo kljub izdelkom low fat … Transmaščobe ... to sem sam govoril že pred leti. Zdaj so negativne učinke za zdravje pri transmaščobah končno le dokazali ... Gonja proti maščobam sploh pa je po moje pretirana. Maščobe so v celici zelo pomembne. Zato opozarjamo na neposredno vlogo živilske industrije pri ohranjanju zdravja prebivalstva.
Se vam zdi, da bi morali (oz. bi bilo to izvedljivo, obstajajo pobude za to?) proizvodnjo antibiotikov uravnavati tako kot področje zdravil za redke bolezni, z nekakšno (med)državno podporo in bi bila tako proizvodnja prosta tržne naravnanosti?
Prav gotovo to drži. Res je, da se na tem področju v zadnjih letih kar nekaj dela. Tudi regulatorne institucije razmišljajo, kako spodbuditi farmacevtsko industrijo k razvoju novih antibiotikov. Kar nekaj predlogov kroži v javnosti. Sami tudi sodelujemo v novi mreži IRAADD (International Research Alliance for Antibiotic Discovery and Development). Vendar v tem trenutku v sami farmacevtski industriji ni bistvenega vlaganja v razvoj novih antibiotikov. Brez njihovega vlaganja pa ne bo šlo.
Katero področje pa v splošnem velja za najobetavnejše, kje iskati novih antibiotikov?
Osnova je že dana v naravi. Vse bakterije vrste aktinomiceta imajo v svojem genomu velik arzenal orožij, t. i. tihih genskih skupin, vprašanje je samo, kako jih zbuditi oziroma pridobiti te spojine v dovolj velikih količinah za testiranje. Nedavno je podjetje Ginkgoo BioWorks (ZDA) pridobilo okoli 100 milijonov dolarjev sredstev od švicarskega Rochea za projekt, ki bo poskusil razviti tehnologijo za obujanje vseh teh genskih skupin. Tako bi lahko prišli do velikega števila novih spojin, ki bistveno presega število učinkovin, ki jih danes že poznamo. Zelo ambiciozen projekt. Potem pa so tu še mikrobi, ki jih za zdaj sploh ne znamo gojiti v laboratoriju, lahko pa izoliramo njihov DNK, ga priredimo in vnesemo v mikrob, ki ga dobro poznamo. Trenutno naša raziskovalna skupina sodeluje pri takšnem projektu s področja sintezne biologije oz. biotehnologije: poznamo nukleotidno zaporedje, ne pa bakterije, ki ji pripada. Gre za evropski projekt EraCoBiotech MISSION, pri katerem sodelujemo tudi z raziskovalci v Leku. Umetno smo sintetizirali 30-tisoččlensko zaporedje DNK-ja, zdaj pa se učimo, kako ga razpostaviti v celici, da bo proizvodnja v celični tovarni uspela. Bioinformatska orodja ti pomagajo, da predvidiš zgradbo in učinek spojine, ki jo kodirajo takšni geni. Če je struktura, glede na genski zapis, zelo podobna znani strukturi, je napoved lahko zelo realna. Na osnovi tega se lahko odločiš, da je neka učinkovina dovolj zanimiva, da jo poskusiš "spraviti v življenje".
Raziskovali ste tudi učinkovino za zaviranje imunskega odziva, takrolimus. Se še ukvarjate z njim ali ste projekt predali naprej?
Imamo podobno molekulo, ki je zdaj v razvojni fazi, zato o njej ne morem povedati več kot to, da je zelo zanimiva. S takrolimusom pa se nismo toliko ukvarjali v smislu razvoja aktivnosti učinkovine, ampak z optimizacijo bioprocesa, in sicer v sodelovanju z Lekom, kjer ga proizvajajo. Težava so bile nečistoče v produktu, ne pa sam donos. Encimi namreč niso vedno precizni – včasih se zmotijo in v snov vgradijo napačno gradbeno enoto. Gre za majhne, a ne nepomembne spremembe v strukturi molekule. Tako dobiš zelo podobno snov, a brez npr. ene metilne skupine ali pa z eno preveč. Takšne spojine med čiščenjem težko ločiš. Uporabiti moraš kromatografsko metodo, kar pa je zelo drago. To seveda tudi bistveno podraži končni produkt, tudi do stokrat. Penicilin npr. stane 10–15 evrov na kilogram, takrolimus pa tudi do 40.000 evrov na kilogram. Tako smo v sodelovanju z Lekovimi raziskovalci razvili proces, ki izboljša učinkovitost proizvodnje. Pri tem smo odkrili povsem novo metabolno pot in to objavili v ugledni reviji. To je Lek tudi patentiral, patenti so podeljeni v Ameriki in Evropi.
Poglejte zgodovino – ko so začeli v medicini izvajati prve transfuzije krvi, je bilo to na začetku za mnoge zelo sporno. Ali danes kdo kaj vpraša? Ne, plemenito je dati kri. Tako bo tudi z GSO-ji, samo da bodo ljudje razumeli, za kaj gre. Pri razvoju novih antibiotikov in mnogih drugih učinkovin in terapij v medicini je tako že danes – nihče ne sprašuje o GSO-jih, čeprav so številne biofarmacevtske učinkovine pridobljene s to tehnologijo. Zadnji primer je zdravljenje otroka, za katerega je slovenska javnost zbrala denar za terapije v ZDA. Tu gre za postopke, ki v celoti slonijo na izjemno napredni genski tehnologiji.
Zanima me, kaj se z zdravili, ki jih vnašamo v telo, dogaja potem …
To je eden od pomembnih vidikov pri razvoju učinkovin. Mnoge pravzaprav delujejo šele, ko se spremenijo v telesu. Sumamed (azitromicin, op. p.) je tak primer. Ta polsintezni eritromicin sam po sebi še ni končna oblika, ampak se modificira v jetrih. To spremembo lahko ugotovijo z vzorčenjem urina. Če spremembe ni, ima snov slabše delovanje. Med kliničnimi testi se tako vrednoti vsebnost in potencialne spremembe pri izhodu iz telesa. Zadrževalni čas je zelo pomemben. Vsaka učinkovina ima svojega. Če ste kdaj dobili sumamed, veste, da gre navadno le za tri tablete. Pri penicilinu pa dobiš po tri velike tablete na dan do 10 dni, saj moraš vzdrževati dovolj visoko koncentracijo učinkovine v krvi.
Tehnološki napredek je zelo hiter. Se vam zdi, da je osebno prirejena obravnava, t. i. personalizirana medicina, že na vidiku?
Na področju rakavih in drugih, npr. degenerativnih obolenj prav gotovo. V splošnem pa osebno individualizirane obravnave pacienta kot rutinskega pristopa v medicini ne pričakujem še tako kmalu. Gre bolj za tipizacijo, razvrščanje v skupino in rutinizacijo tega postopka. Klasična medicina je v preteklosti slonela npr. na histopatologiji, danes pa za potrebe izbora terapije že tipizirajo na podlagi genskih markerjev. Gre pa tu za kompleksno znanstveno področje. Možnost zlorabe je tudi tu izjemna. Zelo me motijo številna manjša podjetja, ki oznanjajo hitro in zanesljivo diagnosticiranje, napovedi o tem, za kakšno bolezen bo "stranka" zbolela, ljudje pa jim kar sledijo. V splošnem je to nekaj pozitivnega: ljudje skrbijo za svoje zdravje, se izobražujejo. Ampak zanesljivo lahko govorimo le o prepoznavanju monogenskih boleznih, npr. cistične fibroze, postaviti diagnozo pri boleznih, ki jih določa več genov, pa je danes po mojem mnenju še velika spekulacija. Gotovo bo prišel čas, ko bo to mogoče, vendar so takšne študije zelo kompleksne in bo potrebno še veliko dela.
Je ob vseh možnostih, ki jih dopušča gensko spreminjanje, še smiselno ohranjati seve, torej "udomačene" in že preizkušene laboratorijske tipe bakterij, ali bi bilo bolje ustvariti novo bakterijo za univerzalno proizvodnjo želenih snovi?
Industrija res poskuša čim pogosteje uporabiti isto vrsto gostiteljskega mikroorganizme, npr. Eschericia coli ali pekovsko kvasovko. Zato te mikrobe pogosto imenujemo "celične tovarne". Tudi genske skupine za biosintezo sekundarnih metabolitov poskušamo izražati v takšnih gostiteljih. A vsak gostitelj ni primeren za vse. Za mnoge produkte se uporablja Escherichia coli, v našem laboratoriju pa razvijamo lasten sistem na osnovi aktinomicete. Ta bakterija namreč izloča ciljni produkt v gojišče, Escherichia coli samo v prostor med membranama, ki jo obdajata. To je prednost aktinomicete, so pa tudi slabosti. Ko torej razmišljaš o produktu, se moraš zavedati, v katerem organizmu produkcija ni primerna. Kvasovka je, recimo, zanimiva: je evkariont, z lahkoto se goji, varna je (status GRAS, generally recognised as safe, op. p.) ... ampak slabost je prekomerna glikozilacija (vezava sladkorjev na ciljni produkt, op. p.), kar načeloma spremeni učinkovitost dane snovi. Tudi celice CHO, na katerih temelji farmacevtska industrija, niso idealne, so pa ta hip najbolj raziskane. Imam kolega, raziskovalca v Nemčiji, ki se prav tako ukvarja s sekundarnimi metaboliti in išče organizem s takšnim univerzalnim delovanjem. Iz narave je že izoliral aktinomiceto, ki izraža veliko število želenih snovi. Zanj so zanimivi takšni gostitelji, ki iz nekega razloga zelo radi izražajo vstavljeno zaporedje DNK-ja. Seveda pa je tega ciljnega produkta navadno zelo malo. Mi, ki smo bolj industrijsko usmerjeni, veliko vemo o organizmih, ki proizvajajo zelo velike količine produkta – od 10 pa vse do 100 gramov/liter – zato vztrajamo pri organizmih, ki jih dobro poznamo. Eden izmed njih je Stroptomyces rimosus: hitro rastoča bakterija, z lahkoto jo transformiramo, uporabljamo vsa moderna orodja, donosi so dobri, papirji urejeni ... Poskušamo razumeti, kako to bakterijo, ki je že optimizirana za industrijsko uporabo in ima izreden donos, malo "sfrizirati", da bi vanjo vnesli gen za drugo učinkovino in bi tudi ta ciljni produkt takoj proizvajala v velikih količinah. Prednost ohranitve starih sevov je velik donos, druga, da so ugodne razmere za industrijsko gojenje že znane, zato je tehnologijo mogoče hitro prenesti v industrijo. Tretja zadeva pa je: regulatorni vidik je pokrit, registracijske zadeve so olajšane, saj so ti organizmi že v uporabi.
Kaj pa mutacije, te so verjetno pogoste?
Seveda, vse genome naših sevov imamo že pregledane (sekvencirane). Ko v organizem vneseš nov gen ali gensko skupino, začne "kašljati", saj na to ni navajen. Takšne genske skupine imajo sicer po navadi tudi gen za odpornost, ampak ni nujno, da se izraža oziroma deluje. Zelo pogosto je produkt toksičen tudi za sam organizem, celo za naravni sev, ki to spojino proizvaja. A v naravi ima dani metabolit povsem drugačno vlogo, ker se vselej proizvaja v zelo majhnih količinah. Veliki donosi, ki jih dosegamo v industriji, zato niso naravni. V času izboljševanja sevov, kar traja tudi več deset let, jih tako izpopolniš, da to zdržijo. Če se nam mudi, lahko razmeroma hitro vzpostavimo sev s produkcijo npr. 5 gramov/liter ciljnega produkta. Seveda pa se zato hitro srečamo s težavami: celice pogosto postanejo bolne, spremenijo obliko, težko rastejo.
Tudi že v industriji uveljavljeni sevi se lahko spremenijo …
To se ves čas dogaja. V bioreaktorjih danes lahko proizvedemo do 80 g penicilina na liter vsebine, izvorno pa je sev proizvajal 0,01 miligrama/liter. Če sev sintetizira toliko določenega produkta, pomeni, da ima veliko metabolnih poti poškodovanih, nedelujočih, preusmerjenih, preveč izraženih ... Industrijski sevi so tako zelo nestabilni, v bistvu so bolni. Prav zato je potrebno stalno preverjanje. To je delo industrijskih biotehnologov, "24 ur na dan", nekateri v industriji delajo le to. Če donos ciljnega produkta pade za 5 %, je to že hud finančni udarec za podjetje.
Kaj pa za industrijo pomeni, če se z mutacijo spremeni profil nečistoč? Kdaj se to opazi in kaj se zgodi z odpadno brozgo?
Groza! Proces čiščenja se mora spremeniti, to pa lahko bistveno vpliva tudi na registracijo procesa in končnega produkta. Hitro se vidi, če gre kaj narobe. Če ena šarža ni v redu, te takoj pokličejo z oddelka za analize. V farmacevtski industriji je ponovljivost in standardna kakovost ključnega pomena. To seveda zahteva veliko znanja in veliko dela, ki podraži končni produkt. Vendar to zagotavlja kakovost in varnost potrošnika, to je pacienta. Kako vzdrževati, shranjevati, obnavljati kulture, je cela znanost. Vsak sev (delovni organizem) se vedno znova testira v laboratoriju in majhnih bioreaktorjih, preden se uporabi na večji, industrijski ravni. Predstavljajte si bioreaktor s prostornino 100 m3 – čiščenje tega je izredno drago. Tudi okoljevarstveno je to velik zalogaj. Vsebino bioreaktorja – tako celice kot proizvajanje snovi – je treba po zaključku procesa "inaktivirati", da gre lahko brozga v čistilno napravo. Če se tam znajde kak antibiotik, lahko uniči mikrobne kulture v čistilnih napravah, t. i. aktivno blato. Ljudje se pogosto ne zavedamo velike odgovornosti inženirjev, ki vodijo te procese. Že majhne spremembe v sestavi dovajanih odpadnih voda namreč lahko vplivajo na delovanje čistilne naprave. Kaj šele, če je produkt zelo toksičen!
Ob vsem naštetem – ste bili v javnosti deležni kakih očitkov zaradi dela z GSO-ji?
Mislim, da je treba strogo ločevati, ali delaš to v zaprtem ali odprtem sistemu. Če delaš z mikrobi, načeloma to pomeni, da iz njih nekaj izoliraš. Seveda še vedno potrebuješ dovoljenje za delo z GSO-ji, ampak laboratoriji so registrirani, procedure ob nesreči so določene, vemo, kako se mikrobe inaktivira. Poleg tega so naši delovni organizmi prepoznani kot varni, so razred 1, imajo celo status GRAS. Izolirani produkt je čist, v njem ni ostankov genske manipulacije. Tako da menim, da na našem področju dela razvoja farmacevtskih učinkovin ni več spornih zadev. Če pa gre zadeva neposredno v hrano, je to nekaj drugega. Mislim, da institucije EU-ja glede tega pravilno postopajo. Da smo nekoliko bolj previdni. V javnosti seveda danes najbolj odmevajo posegi v genom rastlin. Vzemimo za primer novo tehnologijo CRISPR-Cas, saj se o tej metodi danes veliko govori. Nekateri menijo, da CRISPR-Cas ni metoda genske manipulacije – vsaj tako nekako so jo prikazali v ZDA. Na srečo smo v EU-ju bolj previdni. Tu gre prav gotovo za gensko manipulacijo, ki jo v primerjavi s klasičnimi pristopi genske manipulacije teže kontroliramo, kajti CRISPR-Cas lahko deluje manj precizno. To pomeni, da mehanizem uvajanja genske spremembe pogosto ni tako natančen, lahko naredi napake, ki jih raziskovalci ne opazijo. Kakšen pa bo učinek teh napak, tega zagotovo ne veš. Bo prekinjena kakšna druga biosintezna pot, bo aktivirana neka druga metabolna pot? Seveda pa tudi ta tehnologija zelo hitro napreduje, boljši metodološki pristopi so v razvoju in ni dvoma, da bo imela v prihodnosti ključen pomen na področju žlahtnjenja. Odpira nove možnosti, še posebno po bo ta tehnologija imela izjemno vlogo v biomedicini, pri delu s sesalskimi celicami. Tudi v našem laboratoriju uporabljamo in razvijamo to metodologijo.
Kako bi to tehnološko prelomnico komentirali sami?
Z vsako novo tehnologijo prihajajo pomisleki. Potreben je čas, da se metoda izpopolni in dokaže v praksi. Zadeve ne moremo odpraviti kar z besedami, češ da ni nevarna. A v prihodnosti brez GSO-jev prav gotovo ne bo šlo. Pri žlahtnjenju rastlin smo delali prav to, stoletja smo izvajali selekcijo gensko najprimernejših osebkov. Enako pri mikroorganizmih, izvajali smo tudi postopke selekcije z uporabo ultravijolične svetlobe ali mutagenih sredstev. Po svoje je ta pristop še nekoliko bolj tvegan, saj v resnici nismo razumeli, kakšne spremembe smo vnesli v delovno kulturo. Zato je treba ljudem razlagati, kaj so metode genskega spreminjanja, kako delujejo, kakšna so tveganja, pridobiti privolitev javnosti in postopke ves čas nadzorovati. Poglejte zgodovino – ko so začeli v medicini izvajati prve transfuzije krvi, je bilo to na začetku za mnoge zelo sporno. Ali danes kdo kaj vpraša? Ne, plemenito je dati kri. Tako bo tudi z GSO-ji, samo da bodo ljudje razumeli, za kaj gre. Pri razvoju novih antibiotikov in mnogih drugih učinkovin in terapij v medicini je tako že danes – nihče ne sprašuje o GSO-jih, čeprav so številne biofarmacevtske učinkovine pridobljene s to tehnologijo. Zadnji primer je zdravljenje otroka, za katerega je slovenska javnost zbrala denar za terapije v ZDA. Tu gre za postopke, ki v celoti slonijo na izjemno napredni genski tehnologiji.
Vendarle razmišljam, da se javnost obsega uporabe GSO-jev morda ne zaveda povsem.
To je, kot bi kdo meni kot biologu razlagal o računalniških virusih – jaz tega v resnici sploh ne razumem. Težko je pričakovati, da bo nekdo, ki ni iz stroke, temu sledil in to razumel. Zgodovina je jasna – potreben je čas. Če se izkaže, da ni nevarnosti, ljudje to sprejmejo in stvar postane del normalnega življenja. Razmišljam, kako se bo urejalo delo z matičnimi celicami, to je za marsikatero okolje zagotovo sporno področje. Ugotavljam pa, da je rezultat evropske zadržanosti lahko prednost za konkurenco, npr. Kitajsko. Okolja, ki imajo do tega bolj odprt odnos, bodo postala tehnološko močnejša in nas bodo lahko prehitela tudi v gospodarskem smislu. Podobno je z odnosom do rastlinske biotehnologije. Mislim, da javnost ne nasprotuje sami znanosti, temveč bolj posameznim podjetjem. Sporni so monopoli, diktat visoke cene, pehanje za dobičkom.

Kaj pa okoljski vidik? Kaj se s preostanki učinkovine po presnovi v našem telesu dogaja zunaj njega?
Ah, to pa so diskusije! Veste, koliko penicilina na leto konzumiramo v Sloveniji? Po moji oceni okoli 10 ton. Kar izračunajva. V eni tableti je do 1 gram penicilina. Vzamete tri tablete na dan. Pa poenostaviva – po dve tableti deset dni – to je dvajset gramov. Ali lahko rečeva, da povprečen Slovenec dobi penicilin enkrat na tri leta? Torej, na dva milijona … 700 000 x 20 = 14 000 000 gramov oz. 14 ton. In to vse gre iz telesa v okolje!
Če je torej že vaša okvirna ocena za Slovenijo okoli 10 ton, mora biti proizvodnja antibiotikov na splošno izredno velika!
Poglejva samo oksitetraciklin. V prejšnjem stoletju sta ga proizvajala tudi Krka, Pliva, danes pa se pravzaprav ves proizvede na Kitajskem. Tri kitajska podjetja ga proizvajajo in bil sem v vseh treh. Pogledal sem zmogljivosti, se pogovarjal z njihovimi strokovnjaki. Priznavajo proizvodnjo vsaj 10.000 ton letno, po mojem pa je tega do okoli 15.000 ton. Največji bioreaktorji, ki smo jih videli, dosegajo prostornino do 450 kubičnih metrov. Navadno imajo ob teh tovarnah locirane kar lastne termoelektrarne za proizvodnjo elektrike. Proizvod se pakira v polivinilaste žaklje, 20-kilogramske, podobno kot cement. Gre za ogromne količine, ki nam danes omogočajo relativno udobno življenje. Dolgoročno pa je to velik okoljevarstveni problem.
Morda se ga boste dotaknili kdaj v prihodnosti … Koliko projektov pa imate trenutno v ognju?
Hm, odvisno, kako štejete. Ta hip imamo uradno dva evropska projekta, štiri projekte, ki jih delno financira ARRS, od tega enega vodimo sami, drugje smo partnerji ... Ravno zdaj se dogovarjamo za projekt s kolegi iz Hrvaške, ki iz morja zajemajo vzorce in izolirajo DNK organizmov, ki jih v laboratoriju ne znamo gojiti. Imamo tri doktorske študente in še nekaj podoktorskih projektov z gospodarstvom. Kar nekaj, ampak številka je relativna. Ko sem bil v Cambridgeu, nas je bilo le v skupini enega profesorja 75 raziskovalcev, in z neprimerno večjim financiranjem. Kljub temu mislim, da tudi na Biotehniški fakulteti delamo dobro.
Zagotovo veliko odtehta tudi delovno okolje. Kako vam pomaga univerza oz. država? Vas spodbujata?
Naši sistemi so na žalost pogosto precej togi, celo zastareli. Veliko delam z nemškimi raziskovalci in vem, da gre tam uspešnemu raziskovalcu univerza naproti, zaposli koga, da pomaga pri pedagoškem delu, medtem ko moram v Sloveniji še vedno opraviti celotno pedagoško obveznost, torej najmanj 180 ur predavanj. Tudi moj "šef" v Cambridge je imel svoj čas zaposlenega predavatelja. Danes, ko je njegova raziskovalna skupina bistveno manjša, pa pedagoške aktivnosti seveda izvaja v celoti. Bistveno več pomoči imajo v tujini tudi sicer pri administrativnih delih, pripravi pogodb, svetovanju glede inteketualne lastnine ipd. Tudi pri velikih institucijah gre kar velik delež od projektnih sredstev za različne prispevke za delovanje oddelka oz. fakultete. To je normalno. Vprašanje pa je, kaj dobi raziskovalec nazaj: infrastrukturo, podporne storitve, npr. izvajalce analiz, strokovnjake, ki interpretirajo podatke, pridobljene z NMR-jem (jedrska magnetna resonanca, detekcijska metoda, op. p.) in masno spektrometrijo ... Lahko se zares osredotočiš na svoj del projekta. Pri nas sistem tega v resnici ne omogoča, zato je veliko teže ob pedagoškem delu izvajati še zelo obsežno raziskovalno delo. Tudi ko sredstva imam (in me pri zaposlitvi uprava fakultete podpira, to v resnici ni težava), je za kratko obdobje nekaj let praktično nemogoče dobiti raziskovalca s habilitacijo, saj so ti postopki kljub poenostavitvam še vedno zapleteni. Za tujce, ki bi prišli k nam, pa še dodatno neugodni. Mene osebno raziskovalno delo veseli, s tem bi se ukvarjal v vsakem primeru. Je pa treba priznati, da ti to življenja nič ne olajša. Odzunaj je videti, kot da je dela, ko je projekt dobljen, konec, a to ni res. Treba se je udeleževati sestankov, iskati sponzorje, pripravljati poročila, opravljati goro administrativnih del … Seveda, ob tem delati z ekipo. Negovati in razvijati pravo raziskovalno okolje in raziskovalno kulturo. Še teže je pri industrijskih projektih. Odgovornost je še večja. Zelo hitro se lahko zgodi, da izgubiš ugled, ker nisi opravil, kar si v resnici obljubil. To seveda ni neposredna napaka našega vodstva na Biotehniški fakulteti ali univerzi, naš sistem je v osnovi pač tako postavljen, tog in v velikih pogledih zastarel.
Omenili ste doktorske študente. Delajo v tujini? Domnevam, da je za mentorja zelo koristno, da pozna čim več raziskovalcev, ne glede na to, kje se zaposlijo.
Da, imam kar nekaj študentov, ki sedaj delujejo v tujini. Zelo dobro so zaposljivi. Nekateri se potem vrnejo. Smo redno v stiku. Včasih jim pomagam jaz, včasih oni meni – poiščejo kak naslov, podarijo tudi kak aparat, spišemo kak skupen projekt. Doma pa v Sloveniji predvsem delamo z Lekom in Aciesom, ker so vendarle malo bolj raziskovalno usmerjeni. Zdi se mi zelo pomembno, da je univerza stičišče tudi za industrijo. Zato mislim, da morajo biti raziskave tudi na univerzi in so študenti vpeti v delo. V zadnjih petih letih smo s kolegi v dveh laboratorijih znotraj skupine izvedli okoli 40 magistrskih del. Študentje so veliko sodelovali tudi pri industrijskih, raziskovalnih, evropskih projektih, zato tudi bistveno bolj pogosto dobijo službo, še preden zaključijo magisterij. Industrija nas pozna in ve, da se pri nas naučijo konkretnih, aplikativnih zadev, razvijejo delovne navade in dobijo prave izkušnje. Pretok je torej kar dober.
Vrniva s k Aciesu Bio – kakšni so bili začetki? Ste si predstavljali, kaj bo iz tega podjetja nastalo po 12 letih?
Ko začneš, ne razmišljaš veliko. Na začetku je treba predvsem preživeti. Treba je postaviti podjetje na noge. Ko sem dobil prvi štiriletni industrijski projekt – še na univerzi – sem ugotovil, da ga bo težko izvesti v okviru okolja na fakulteti. Univerza ima določene omejitve glede sodelovanja z industrijo. Recimo: želiš kupiti aparat. Najdeš opremo, staro eno leto, v odličnem stanju, za polovično ceno. S tem bi veliko prihranil, a na univerzi to ni mogoče. Izvesti moraš razpis, oprema mora biti nova, postopek traja. Postalo nam je jasno, da če želimo razvijati nove industrijske tehnologije, potrebujemo neodvisno podjetje. Bilo je nekaj zelo zagnanih, podjetnih študentov in odločili smo se, da ga ustanovimo. V Sloveniji pa to zakonodajno v resnici ni rešeno. Spin out, spin off, kakor koli že se reče, to ni določeno, zakonodaja za takšne procese ni dorečena. Na začetku je bilo zato z Aciesom Bio zelo težko. Ko smo našli vlagatelja, ki nam je dal bančno garancijo, potem pa je steklo. Imeli smo zanimive projekte, vlagatelj je gledal dolgoročno, zato se je izšlo.
Na področju novih antibiotikov je trenutno velika kriza. Ko bo prva epidemija, bodo verjetno spet zanimivi, sicer pa za razvoj antibiotika med farmacevtskimi podjetji ni velikega zanimanja. Antibiotiki so tista zdravila, ki so za razvoj precej draga, po drugi strani pa je izkupiček od prodaje za farmacevtska podjetja razmeroma slab. Uporabiš jih namreč le nekajkrat, v kratkem časovnem obdobju, zelo močne antibiotike sploh zelo redko. Za primerjavo, zdravilo proti zvišanemu krvnemu tlaku pacient prejema vse življenje, kar za podjetje predstavlja konstanten zaslužek. Faramacevtski industriji se razvoj antibiotikov preprosto ne izplača.
Če bi to pot primerjali z ureditvijo v Angliji, na kaj bi opozorili?
V Angliji je zagnati podjetje razmeroma enostavno. Ko se je moj šef na Univerzi v Cambridgeu odločil ustanoviti podjetje, je bila univerza takrat takoj 30-odstotni lastnik. Tako odpadejo vse dileme, ni neugodnega položaja, da bi ustanovitelju kdo očital konflikt interesov – nihče se ne sprašuje, ali profesor dela za univerzo ali za zasebnika. Univerza tako lahko tudi upravlja podjetje. Za to imajo danes pogosto uspešne univerze ustanovljene posebne neodvisne inštitucije (v lasti same univerze), ki podpira in pomaga razvijati takšna mlada podjetja. Pri nas je treba v ta namen vse jasno opredeliti, tam – v Cambridgeu – pa v osnovi ne. Če želiš ustanoviti podjetje, greš do vodstva univerze in jim predstaviš svoje rezultate. Podjetje je lahko na univerzi ter ta podjetju oddaja prostor, ali pa se to dogaja v za to posebej postavljenih prostorih, t. i. "inkubatorjih". Vse je mogoče. Univerzi je ustanovitev vedno v interesu, saj dobi svoj delež – navadno gre za nadzorni delež minimalno 25 % in še ena delnica –, ki ga lahko univerza nekoč tudi proda. Kot solastnik univerza v "upravo podjetja" postavi še eno osebo, ki pa ni raziskovalec, ampak je načeloma iz univerzitetne uprave. To je precej spontano, ni omejitev, profesor lahko normalno dela, dobi celo dodatno plačo, obstaja pa stalen nadzor v upravnem odboru. To, da lahko univerza kot javna institucija neposredno sodeluje z lastniškim deležem v razvoju podjetja, je izjemno pomembno. Saj – najpogosteje – samo odkritje ali razvoj nove tehnologij še ni komercialno uporabno. Zato so potrebne dodatne investicije in nadaljnje razvojno delo, ki nato šele pokaže komercialno vrednost nove tehnologije, kar rezultira v finančnem učinku, v dobrobit vseh deležnikov, raziskovalcev, univerze in investitorjev. Pri nas pa javna ustanova načeloma ne more biti lastnica zasebnega podjetja. To zares otežuje ustanavljanje podjetij neposredno kot rezultat raziskovalnega dela na univerzi in ta težko upravlja svojo intelektualno lastnino.
Pa se tuje univerze ne bojijo, da bi tako izgubile dobre profesorje, če bi se povsem posvetili gospodarstvu?
Videl sem že, da je profesor odšel z univerze, ampak zelo pogosto profesor na univerzi ostane. Navadno sodeluje pri ustanovitvi podjetja, posle pa vodi postavljena uprava. Profesor nudi podporo, je kot nekakšen "strokovni direktor", ki predvsem svetuje. Akademike navadno zanima znanost. Zato je univerza za njih pravo okolje.
Ko takole razmišljam, moram reči, da je vsaj ena dobra stran projektov – raznolikost. Projekti so zagotovilo, da se ves čas lotevate česa novega.
Zato sem na univerzi … Pri projektih je odvisno, za kateri tip gre. So bazične, zares bazične raziskave –in na drugi strani aplikativne. V Sloveniji je v gospodarstvu do prvih pogosto čutiti negativen odnos, ampak v resnici je zares kakovostnih bazičnih raziskav pri nas zelo malo. Prave temeljne raziskave pomenijo nekaj novega, zato so v resnici zelo pomembne. Ampak – ne more biti bazična raziskava raziskava ta, ki se enkrat predstavlja kot bazična, drugič kot aplikativna. To se pri nas zelo pogosto dela. Jaz sem zelo aplikativno naravnan, ampak zavedam se, kako zelo pomembna veja znanosti so bazične raziskave. Premalo jih je. Pravi razvoj, veliki preskoki in tehnološki preboji se zgodijo kot rezultat bazičnih raziskav.
To se dotika še enega področja, ki vam je domače – patentov. Nekaj jih že imate. Kako presodite, kaj je smiselno patentirati?
Na začetku, v času izvedbe projekta, velikokrat ne moreš reči, kaj je vrednost. Pomembno je, da se to področje intelektualne lastnine primerno organizira. Mi tega še nimamo povsem urejeno. Če vložim patentno aplikacijo, je vedno vprašanje, kdo bo pokril stroške. Na začetku so ti sicer razmeroma majhni. Patentna aplikacija pa pomeni tudi ogromno znanja. Specializirana služba za to na univerzi obstaja, vendar je danes njeno delovanje še relativno omejeno. V preteklosti pa nismo imeli kake podpore in prave strokovne pomoči. Večina dela spet sloni na raziskovalcu, zato potrebuješ zunanjo pomoč. Mi sodelujemo z neko nemško patentno družbo, ampak patentnik stane vsaj 200 evrov na uro, pa je to pravzaprav ugodna cena za akademike. Za eno patentno aplikacijo patentni strokovnjak pogosto porabi kakšnih 30 ur. Torej, že priprava takšne aplikacije kar nekaj stane. Patenti in njihova priprava so cela umetnost. Ti že poskrbiš za znanstveni del, pomembno pa je, kako predstaviš zadevo, postaviš zahtevke ... Seveda, na velikih univerzah imajo več sredstev, imajo tudi veliko več posluha, tam so razmere seveda neprimerno boljše.
Se patenti upoštevajo pri prijavah za projekte?
Agencija ARRS pri točkovanju to upošteva kot družbenoekonomski in raziskovalni dosežek. To je dobro.
Ampak patent pogosto ne zadeva zgolj iznajditelja oz. je teh več. Kako je s tem?
S partnerjem (npr. iz industrije) se dogovoriš, kdo je inventor ... Pri nas tega še ne uporabljamo pogosto, ampak v svetu intelektualne lastnine že obstajajo nekakšni vprašalniki za opredelitev, kdo je zares intelektualno prispeval. Na osnovi tega se določijo avtorji. Avtor patenta ni kar avtomatično npr. vodja projekta, ampak tisti, ki je k njemu največ prispeval. Včasih je avtorstvo težko jasno opredeliti. Lastništvo je pa druga stvar. Če delaš v podjetju, inventor/raziskovalec ni lastnik, kajti podjetje je vložilo sredstva v raziskave. Raziskovalec je upravičen do moralnih pravic ... Dobra podjetja imajo za inovatorje nagrade. Vem, da imajo nekaj takega urejeno v Leku. V Nemčiji je to še nekoliko bolj urejeno, inventorju lahko pripada določen delež. Tako spodbujajo razvoj.
Vrniva se domov na univerzo … Kako je v znanstvenem svetu pozicionirana Biotehniška fakulteta oz. Univerza v Ljubljani, kako ugledna je?
Biotehniška fakulteta je velika, več kot 500 raziskovalcev in drugih sodelavcev nas je, ki omogočamo, da takšen sistem deluje na pedagoškem in raziskovalnem področju. Naša organizacija je kar unikatna in mnoge fakultete po svetu nam to zavidajo. Zaradi tega z nami tudi radi sodelujejo, kar je razvidno iz projektov, izmenjav in drugih virov informacij. Lahko vam povem iz prve roke, da so izjemno zadovoljni z mladimi raziskovalci, študenti MSc-študijev, ki pridejo delat v tujino, prek projektov Erasmus ali pa drugih raziskovalnih projektov v obsegu EU-ja, industrijskih sodelovanj in podobno. Biotehniška fakulteta je do zdaj kar dobro vzdrževala svoj ugled, a okoliščine na razvojnoraziskovalnem področju in področju pedagoškega dela se po svetu zelo hitro spreminjajo. Mene osebno nekoliko skrbi, ali nam bo uspelo zadržati trende v raziskovalnem delu naših aktivnosti, saj je konkurenca v nacionalnem, kot tudi v mednarodnem okolju, izjemna. Bojim se, da postajamo vedno bolj fakulteta, ki se pretežno ukvarja s pedagoškim delom, in da nismo dovolj agilni pri raziskovalno-razvojnih aktivnostih. Američani pogosto opredelijo, da imajo dva tipa univerz, "teaching-oriented universities" in "research-oriented universities". Zdi se mi, da se počasi nagibamo k tistim prvim, bolj v "teaching-orjented university". Po mojem mnenju to ni najbolje. Vprašanje je, ali bomo zmogli na dolge steze (ko bom jaz že zaključil svojo kariero) "peljati enako uspešno po obeh tirih". Moram pa povedati, da se o tem veliko pogovarjamo in da vodstvo raziskovalno dejavnost podpira in spodbuja.
Rekli ste, da tuje ustanove z vami rade sodelujejo. Nam poveste kaj več o tem?
Zdi se mi, da sodelovanje nikoli ni bilo težava. Zelo veliko sodelujemo z bližnjimi državami. Pa tudi z ZDA. V zadnjem času pa opažam, da vedno več k nam prihajajo delegacije iz Kitajske in Japonske in tudi mi smo veliko v stiku z njimi. Sam sem v preteklosti zelo veliko sodeloval s kitajskimi raziskovalci, tako na univerzah kot tudi v industriji. Zdi se mi, da smo nekako kompatibilni. Mogoče nam tu pomagajo naše izkušnje, še iz časa Jugoslavije. Čeprav je sodelovanje pogosto tehnično zahtevno, pojavljajo se težave v komunikaciji, so bile moje izkušnje zelo pozitivne. Glede na izjemen razvoj znanosti in gospodarstva v Aziji, se mi to zdi izjemnega pomena, stvar, ki jo je vredno izkoristiti. V raziskovalne in gospodarske namene.
Pa je sodelovanje z zunanjimi institucijami, tako slovenskimi kot tujimi, prepuščeno iniciativi posameznika ali obstaja želja po skupnem nastopu, po trdnih raziskovalnih jedrih znotraj fakultet?
Res je, da je tu v veliki meri prepuščeno iniciativi posameznika. No, po svoje je to v akademskem okolju normalno. Namreč, raziskovalno delo na univerzi za samega raziskovalca pri nas ni zelo “profitabilno”. Če izračunam, koliko je moja realna ura plačana, če štejem vse ure dela ob večerih in ob koncu tedna, tu ni "profita". Raziskovalec mora torej biti v veliki meri zares entuziast in samoiniciativen, če hoče biti uspešen. O tem sem trdno prepričan. To velja tudi na velikih univerzah v tujini. Vendar pa je res, da se je treba organizirati v večje skupine, večje projekte in nastopati skupaj. Pa ne le znotraj same fakultete, tudi z institucijami zunaj fakultete. Treba je aplicirati za večje projekte, tudi finančno močne projekte, in ustvarjati večja raziskovalna jedra. Nekaj takšnih primerov imamo tudi na BF-ju, vendar prav gotovo premalo.
Se pa tu ponovno postavlja vprašanje organizacije raziskovalne dejavnosti na fakulteti. Po pravici povedano, sam komaj zmorem voditi delo v obsegu obstoječih projektov, ob vseh pedagoških aktivnostih. Brez dela ob koncu tedna in večinoma vseh praznikih, torej uradno dela prostih dneh, ne gre. In tisti, ki zares delamo na raziskovalnem področju, in teh je na fakultetah kar veliko, bi s težavo prevzeli nase še večjo količino dela. Priprava velikih projektov je pač ogromen zalogaj. Ponavljam, gre za vprašanje organizacije dela.
Kaj pa naravoslovnim fakultetam pomeni odpiranje univerze za tuje študente in predavatelje? Vprašanja gostovanj ste se v svojem odgovoru že rahlo dotaknili.
To je danes zelo pomembno izvajati. S tem se povečuje kompetenca fakultete. Tudi prepoznavnost v tujini. Zelo koristno bi bilo, da bi poleg študentov na univerzo prihajali kakovostni raziskovalci iz tujine. Tako povratniki Slovenci kot tudi tuji raziskovalci. Se pa bojim, da ta proces v realnem življenju ne poteka, med drugim zaradi različnih preprek administrativne narave. No, tudi za to je verjetno potreben čas.
V nacionalnem kontekstu je to zanimivo zaradi položaja slovenščine.
Seveda, tudi to je področje, ki ga ni enostavno opredeliti. Ni npr. realno pričakovati, da bo iz tujine v Slovenijo prišel kakovosten tuji raziskovalec za daljše obdobje, glede na sistem, ki ga imamo. Tudi če bi v Sloveniji imel idealne razmere za delo, kar v večini primerov nikakor ne drži. Če pa se od tujega raziskovalca zahteva še znanje slovenščine (še preden pride v Slovenijo), potem je to prav gotovo "misija nemogoče". No, težko sodim, kaj tu narediti.



































































Komentarji so trenutno privzeto izklopljeni. V nastavitvah si jih lahko omogočite. Za prikaz možnosti nastavitev kliknite na ikono vašega profila v zgornjem desnem kotu zaslona.
Prikaži komentarje